

Cálculos estequiométricos
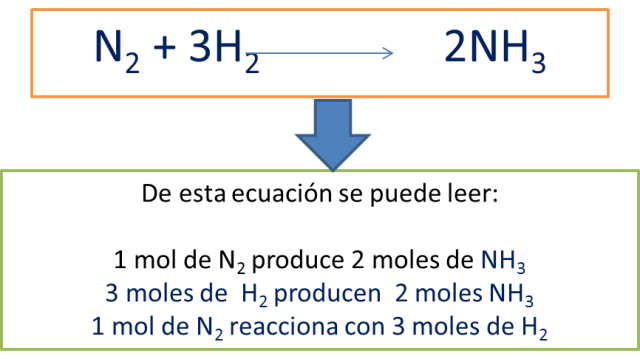
Para aprender estequiometría primero debes saber interpretar la información que entrega una ecuación química, veamos:
CÁLCULO DE ÁTOMOS Y MOLÉCULAS
Podemos calcular la cantidad de átomos que se encuentran presentes en un compuesto o el porcentaje en peso que tienen esos elementos en el compuesto, para hacerlo se debe conocer el peso atómico de cada elemento:
Por ejemplo para saber el porcentaje en peso de cada elemento en el compuesto H2SO4 debemos tener en cuenta:
| Elemento | Peso atómico |
| H | 1.00g/mol |
| S | 32.065g/mol |
| O | 16.000g/mol |
Por lo tanto una mol de H2SO4 equivale a 1g/mol de H x 2 = 2g/mol de H
32.065 g/mol = 32.065 g/mol de S
16.000g/mol x 4= 64 g/mol de 0
Se deben sumar todos los datos obtenidos así: 2 + 32.065 + 64 = 98.065 g
Los porcentajes en peso de cada elemento en el compuesto se calculan así:

Uso del Número de Avogadro:
El número de Avogadro es la cantidad de átomos presentes en 12g de Carbono. La cantidad de sustancia presente en este valor se conoce como mol.
Por lo tanto, en lugar de contar átomos u otras partículas unitarias, se cuentan moles.
1mol=6.022x1023
Ejemplos:
1mol de azufre = 6.022x1023 átomos de azufre = 32.06g de S
1mol de cobre = 6.022x1023 átomos de cobre = 63.55g de Cu
1mol de agua = 6.022x1023 moléculas de agua = 18 g de H2O
Para calcular cuántos átomos o moléculas hay en un elemento o compuesto, se utiliza el número de Avogadro.
Veamos: ¿Cuántas moléculas de HCl hay en 25g de HCl?

¿Cuántos átomos hay en 0.551g de K?



Fórmula empírica y fórmula molecular
La fórmula empírica indica el número relativo de átomos (o de moles) de los elementos que conforman un compuesto. Recibe este nombre porque se determina de forma experimental.
Debes saber que la fórmula empírica se expresa utilizando los números enteros más pequeños posibles.
Para calcular la fórmula empírica (mínima) de un compuesto se debe tomar como base 100g de compuesto, pues generalmente se dan los porcentajes en los que se encuentra cada elemento en el compuesto.
Veamos:
En el laboratorio se determina de forma experimental que un compuesto está formado por 40% de C; 6.7% de H y 53% de O
¿Cuál es la fórmula mínima del compuesto?
Recordemos que se debe tomar como base 100g del compuesto, esto se traduce en que tenemos:
40g de C
6.7g de H
53g de O
Para determinar las moles de cada elemento se divide por 1mol de cada uno, es decir, por su masa molar (se obtiene de la tabla periódica)

Esto quiere decir que los elementos están en la siguiente proporción por moles de átomos:
3,3: 6,7: 3,3
Para obtener los valores numéricos divido por el número más pequeño.
C 3,3/3,3= 1
H 6,7/3.3= 2.0
O 3.3 /3.3= 1
Otro ejemplo:

Ejercicio tomado de:http://www.alonsoformula.com/inorganica/_private/PROBLEMA205.pdf
Observa el siguiente video para ampliar la información
Recurso tomado de:https://www.youtube.com/watch?v=IQR2UVWv6ik
Profesor Jorge Cogollo
Cálculos mol-mol
Para hacer cálculos estequiométricos a partir de una ecuación o de una situación problema debemos tener en cuenta los siguientes aspectos:
1. Determinar si en la situación me dan la ecuación y si ésta se encuentra balanceada
2. Determinar los términos en los que me plantean la situación (si todo está en términos de masa, de moles o si es combinado masa-moles)
3. Identificar el factor de conversión según lo que me piden hallar.
4. Plantear la ecuación y resolver el ejercicio.
Ejemplos: Cálculo mol-mol
Cuántas moles de amoniaco se forman cuando 405 moles de hidrógeno reaccionan con nitrógeno según la ecuación:
N2 + 3H2 → 2NH3
1. Primero debemos identificar si la ecuación está balanceada
2. Determinar lo que me piden hallar y los datos que tengo: en este caso me preguntan por moles de NH3 y me dan moles de Hidrógeno
3. Planteo el factor de conversión apropiado según el caso:
De la ecuación balanceada puedo deducir que por cada 3 moles de H2 se producen dos moles de NH3 esto me indica que el factor de conversión a utilizar es:




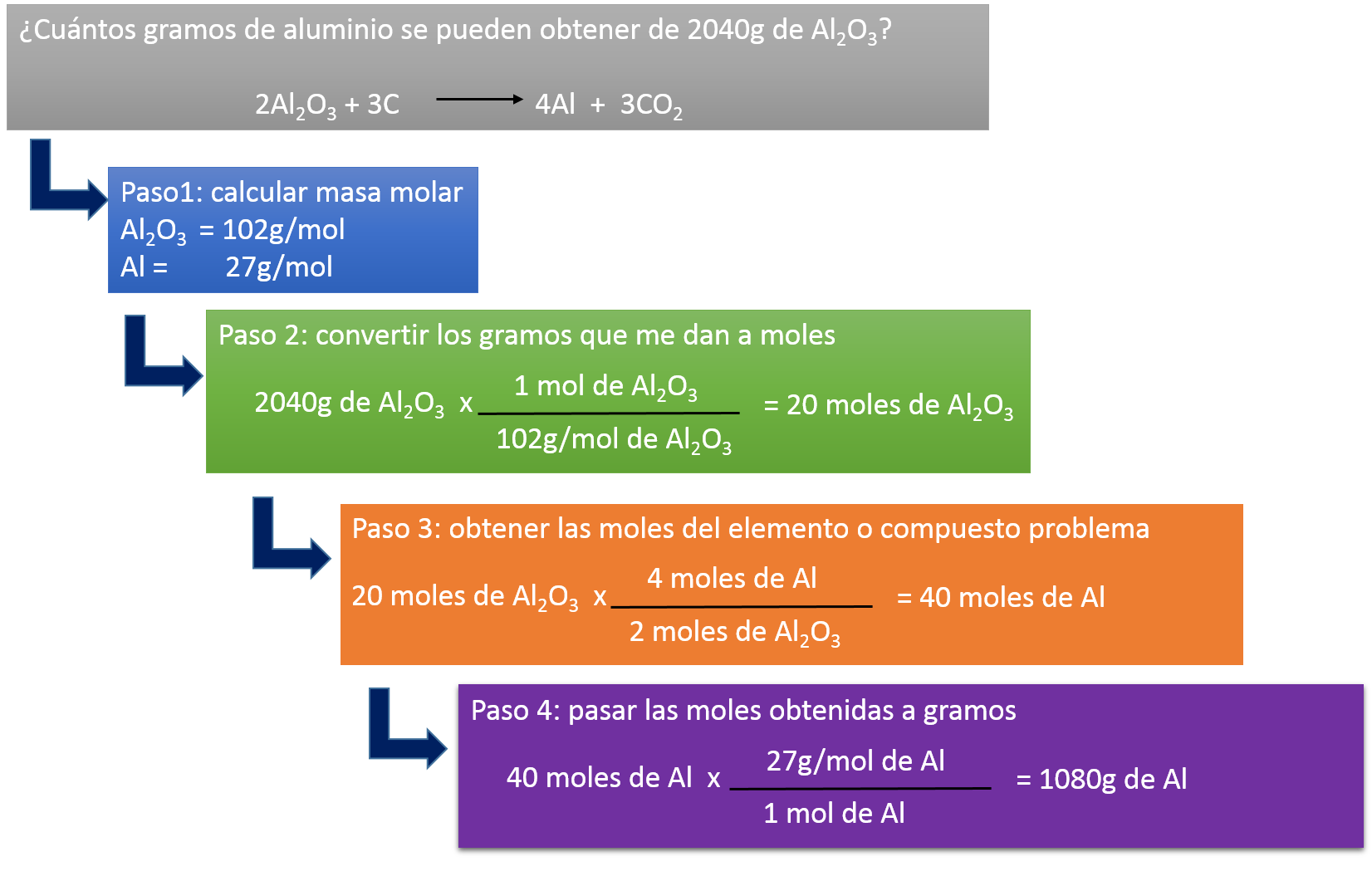
Cálculos masa- masa
Cuando nos dan la situación problema con las masas de los reactivos y los productos es importante recordar los conceptos de peso molecular y peso atómico, pues son necesarios para resolver los ejercicios.
Ejemplo:
2NaCl → 2Na + Cl2
| Sustancia | Masa molar |
| NaCl | 23 + 35.5 = 58.5g/mol x 2= 117g/mol |
| Na | 23 g/mol x 2 = 46 g/mol |
| Cl | 35.5 g/mol x 2 = 71 g/mol |
3. Se establecen los datos con los que se hará el cálculo solicitado:
En este caso nos piden los gramos de NaCl con 580 g de Cl, por lo tanto no tendremos en cuenta el Na
4. Escribir la ecuación con el factor de conversión requerido:
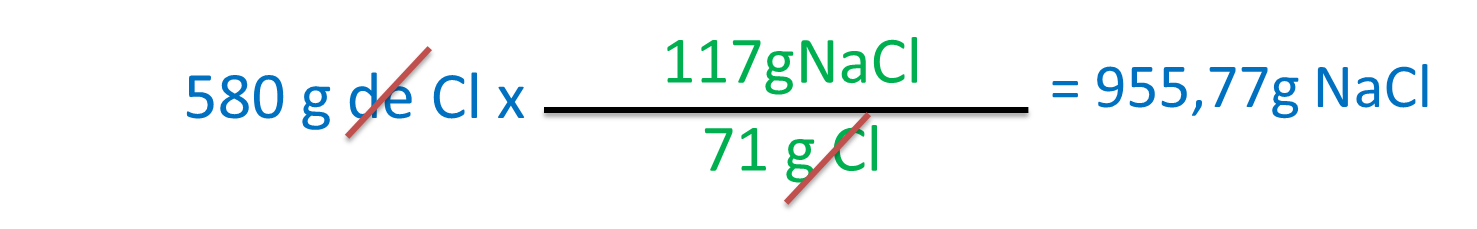
También se puede resolver por regla de 3 así:
Xg ------- 580g
117g ------ 71g
X= (580x117)/71g = 955.77g NaCl
En resúmen se necesitan 955.77g de NaCl para producir 580g de Cl.



Ingresa al siguiente link y resuelve cada uno de los ejercicos en el cuaderno. Comprueba tus respuestas
http://www.eis.uva.es/~qgintro/genera.php?tema=4&ejer=3
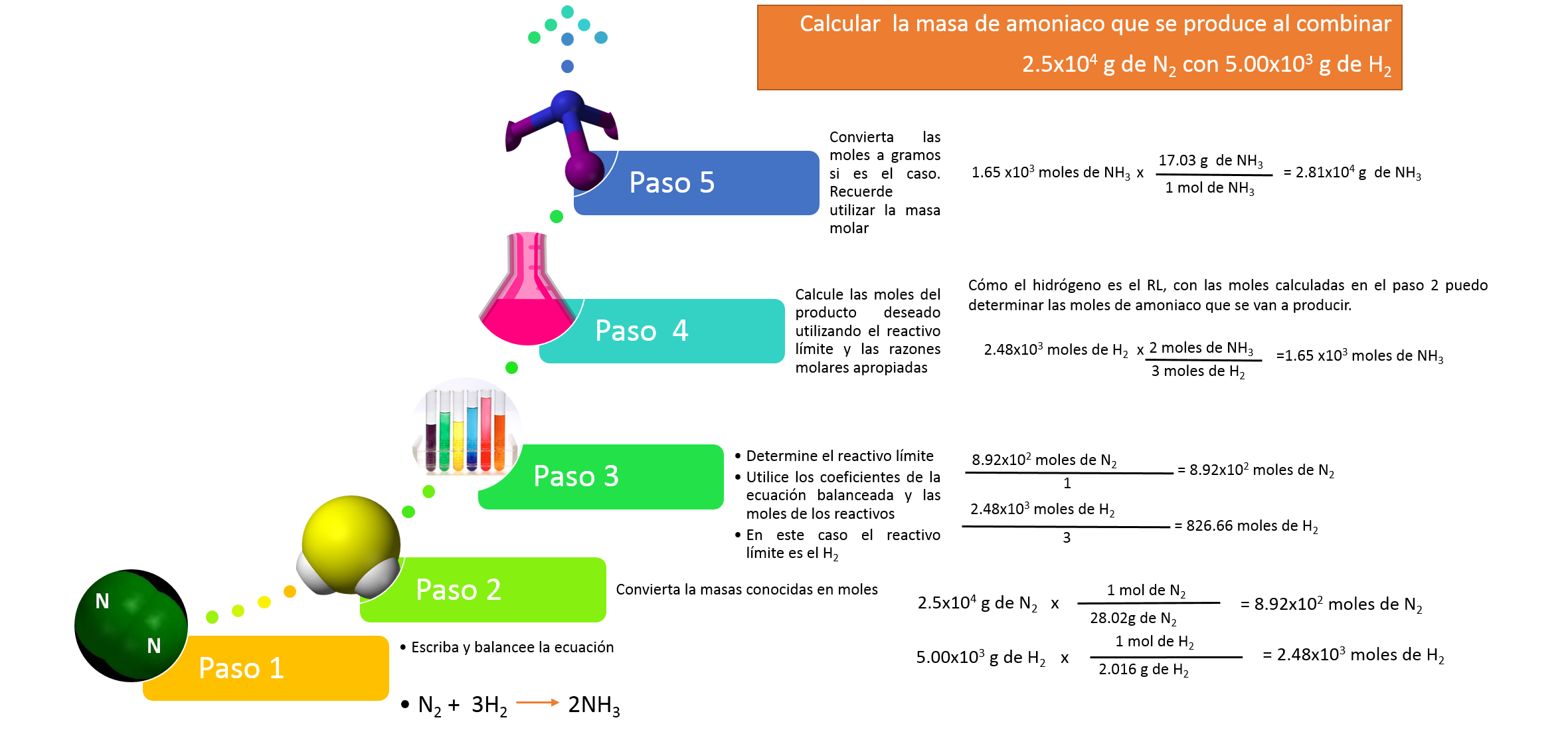
Reactivo límite
Hasta el momento se han tratado situaciones en las que los reactivos se consumen totalmente para dar orígen a los productos, pero existen reacciones en las que no todos los reactivos se consumen totalmente, es decir, hay una sustancia que se agota más rápido que la otra y por lo tanto ésta quedará en exceso.
Al reactivo que se agota primero se le conoce como reactivo límite RL (reactivo limitante)
Para determinar el RL en un ejercicio, se calculan las móles de cada sustancia que interviene en la ecuación y se divide por su respectivo coeficiente en la ecuación balanceada. El menor cociente será el RL.



Ingresa al siguiente link y resuelve cada uno de los ejercicos en el cuaderno. Comprueba tus respuestas
Ejercicios de reactivo límite
http://www.eis.uva.es/~qgintro/genera.php?tema=4&ejer=4
Recurso tomado de http://aprende.colombiaaprende.edu.co/sites/default/files/naspublic/ContenidosAprender/G_10/S/S_G10_U02_L01/S_G10_U02_L01_03_04_01.html#
