REACCIONES QUÍMICAS
Cómo identificar que ocurre una reacción química:

Una reacción química, siempre implica que ocurre un cambio químico, es decir, a partir de una o varias sustancias se forman otras sustancias nuevas, con características químicas diferentes a las originales.
En una reacción química la cantidad de átomos de los elementos o compuestos que participan en la reacción son iguales a los que salen en los productos, esto indica que no pueden aparecer átomos diferentes en los productos si no participaron en la reacción o que en el proceso de formación no se pueden “desaparecer” átomos. A esto se le conoce como ley de la conservación de la materia (masa).
ECUACIÓNES QUÍMICAS

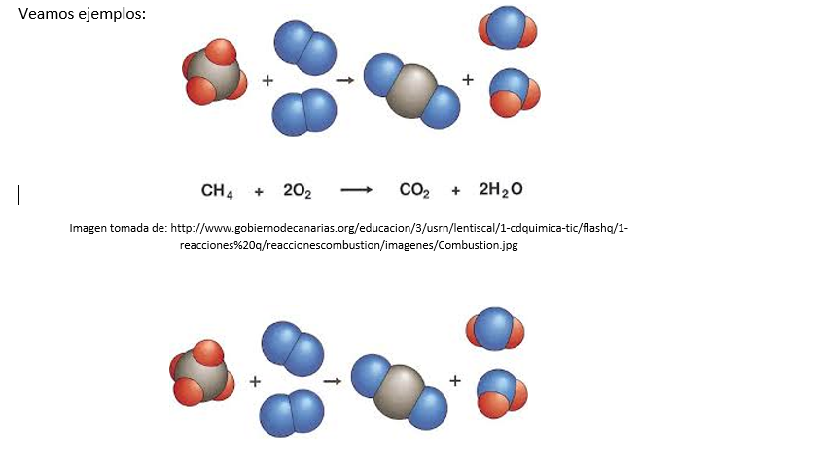 |
 |
 |
Clasificación de las reacciones químicas
 |
 |
 |
Balanceo de ecuaciones químicas por el metodo de tánteo
Para balancear por tanteo, se colocan coeficientes al inicio de cada compuesto (si es necesario) para que queden en iguales cantidades tanto en los reactivos como en los productos. NUNCA se cambian los subindices de los compuestos porque esto implica que se cambia la naturaleza y propiedades del mismo.
1. Primero se balancean los átomos diferentes a O e H.
2. Empezar con los elementos metálicos, luego los no metales o por el que se encuentra presente en menos sustancias.
N2 + H2 → 2NH3
En este caso colocamos el coeficiente 2, en el producto, porque hay una molécula diatómica de nitrógeno en los reactivos,
por lo tanto en los productos también tiene que existir 2 átomos de nitrógeno.
3. El hidrógeno y oxígeno quedarán para el final. En este caso balanceamos el hidrógeno porque no hay oxígeno:
N2 + 3H2 → 2NH3.
Se agrega el coeficiente 3 en los reactivos, porque al multiplicar el coeficiente que tiene el producto, por el subíndice
que tiene el hidrógeno en los productos, tenemos 6 hidrógenos, esto indica que en los reactivos deben existir 6 hidrógenos,
por lo tanto agregando 3 multiplicamos 3x2 y tenemos 6 hidrógenos.
Ejemplos:
6CO2 + 6H2O → C6H12O6 + 6O2
Como sugerencia, para saber si esta correcto el balanceo se cuentan la cantidad de átomos en los reactivos y en los productos Así:
C = 6 C= 6
O = 18 O= 18
H = 12 H=12
Veamos un ejemplo con el modelo molecular

Imagen tomada de: http://aprendeenlinea.udea.edu.co
Balanceo de ecuaciones por el método de oxidación-reducción (Redox)
Las reacciones de óxido – reducción o REDOX son aquellas donde está involucrado un cambio en el número de electrones asociado a un átomo determinado, cuando este átomo o el compuesto del cual forma parte se transforma desde un estado inicial a otro final.
En las reacciones Redox, ocurren dos procesos, uno de reducción y otro de oxidación. Debemos entender que:
REDUCCIÓN: Implica que hay ganancia de electrones
OXIDACIÓN: Implica pérdida de electrones
 |
 |
 |
 |
 |
 |
 |
 |
 |
Para saber más
Recurso tomado de:http://portalacademico.cch.unam.mx/alumno/aprende/quimica1/balanceoecuaciones
Ejercicios de balanceo
Recurso tomado de: http://www.fisica-quimica-secundaria-bachillerato.com/animaciones-flash-interactivas/quimica/balancear_ajustar_ecuaciones_reacciones_redox.htm
Recurso tomado de:http://www.lamanzanadenewton.com/materiales/aplicaciones/lrq/ai_ex07.html










